
L’Agence européenne des médicaments (EMA) a annoncé en octobre 2024 l’adoption de la ligne directrice très attendue sur la qualité et l’équivalence des produits topiques. Le document final, élaboré en 2018, entrera en vigueur en avril 2025 sous le titre officiel de « Ligne directrice sur la qualité et l’équivalence des produits cutanés à application locale et à action locale ».
Nos services IVRT et IVPT ainsi que d'assurance qualité ont synthétisé les points essentiels de la directive de l'EMA concernant l'IVRT et l'IVPT, en les classant entre les recommandations qualité et la section relative à l'équivalence thérapeutique. Ils ont également partagé l'expérience du groupe Kymos en matière de mise en application de cette directive depuis sa précédente version préliminaire en 2018.
Quelles sont les nouvelles lignes directrices de l’EMA sur les produits topiques pour 2024 ?
Comme son titre l’indique, cette directive concerne les médicaments à usage cutané et à action locale, mais peut également s’appliquer à d’autres produits tels que les préparations auriculaires ou ophtalmiques et les produits vaginaux à action locale. Ce nouveau règlement, qui comprend des recommandations de qualité et d’équivalence, introduit une approche plus structurée de l’évaluation des produits cutanés.
La seconde partie relative à l’équivalence ne s’applique pas aux médicaments biologiques, aux médicaments à base de plantes, aux produits dont l’équivalence d’efficacité est démontrée par des essais cliniques, ni aux produits dont la forme pharmaceutique du produit testé et du produit de référence diffère. Cette exclusion est particulièrement importante pour les formes galéniques à absorption systémique, telles que les patchs transdermiques.
Avec ces récentes mises à jour, l’EMA met l’accent sur une approche plus structurée et progressive qui devrait simplifier le processus de démonstration de l’équivalence thérapeutique en se concentrant sur les méthodes in vitro (test de libération in vitro ou IVRT et test de perméation in vitro ou IVPT) et pharmacocinétiques (PK) qui présentent des alternatives économiques et rapides aux études cliniques.
Recommandations de qualité pour les produits topiques
Les recommandations de qualité de ces lignes directrices s’appliquent aux nouvelles demandes d’autorisation de mise sur le marché et aux modifications post-autorisation des produits non couverts par d’autres lignes directrices ou par les normes pertinentes de la Pharmacopée. Concernant l’IVRT et l’IVPT, les aspects les plus pertinents de ces lignes directrices sont les suivants :
Développement pharmaceutique
-
Développement de la formulation
Le développement de la formulation doit être aligné sur le QTTP (Quality Target Product Profile), avec des tests appropriés pour caractériser et contrôler les CQA (Critical Quality Attributes) tels que la facilité d’administration, la durée d’utilisation et les performances du produit comme la dissolution, l’IVRT et, le cas échéant, l’IVPT.
-
Caractérisation du produit
La caractérisation est nécessaire pour faciliter la gestion du cycle de vie et, le cas échéant, l’équivalence des produits. Les principaux tests de performance doivent inclure la dissolution des suspensions, le test IVRT et, si nécessaire, le test IVPT. La stabilité des performances du produit pendant le stockage doit être démontrée.
Stratégie de contrôle
Les attributs critiques de qualité (ACQ) essentiels au contrôle de la libération du médicament doivent être gérés avec soin, notamment par des tests tels que l’IVRT et l’IVPT (le cas échéant). D’autres paramètres (microscopie, DSC, rhéologie, etc.) peuvent être utilisés s’ils se révèlent plus discriminants pour le contrôle de la libération du médicament. De plus, les limites des tests de performance (dissolution, IVRT, etc.) incluses dans le cahier des charges doivent être justifiées par des références à des lots cliniques dont l’efficacité et l’innocuité sont démontrées.
Programme de stabilité
Les tests de stabilité doivent garantir la qualité et l’efficacité du produit au fil du temps, les tests IVRT ou autres tests de performance confirmant la constance de la durée de conservation.
Recommandations d’équivalence pour les produits topiques
Cette partie des lignes directrices s’applique aux nouveaux produits cutanés qui souhaitent démontrer leur équivalence thérapeutique avec un médicament existant. Elle s’applique également aux modifications apportées après l’autorisation de mise sur le marché lorsqu’un impact potentiel sur la qualité, la sécurité ou l’efficacité est attendu après une évaluation des risques.
Le guide précise également que « dans le cas des demandes qui s’appuient sur la littérature pour démontrer l’innocuité et l’efficacité du médicament, la pertinence de la littérature doit être étayée par des données d’équivalence avec le produit décrit dans la littérature ».
Comme indiqué précédemment, l’EMA recommande une approche par étapes pour démontrer l’équivalence. Cela permet aux fabricants de produits pharmaceutiques de savoir à l’avance quels tests réaliser pour leurs produits (formulations simples telles que des solutions ou des gels, ou formulations complexes comme des émulsions), et son objectif principal est d’éviter des études cliniques complètes.
Pour choisir l’approche et l’arbre de décision à sélectionner, l’EMA prend en considération la composition qualitative, la composition quantitative et la caractérisation physico-chimique et structurale des produits cutanés :
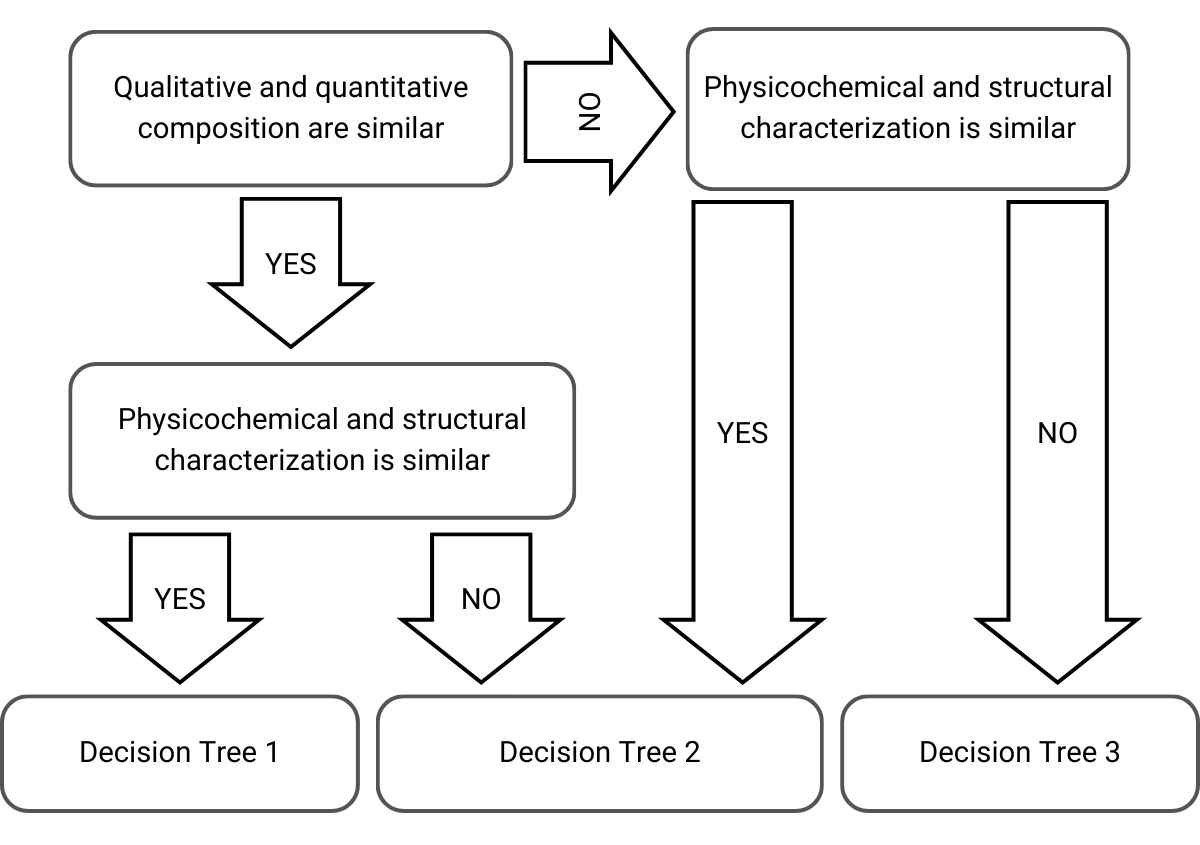
Figure 1) Sélection de l’arbre de décision dans l’approche par étapes adaptée des lignes directrices de l’EMA
Ensuite, en fonction de ces considérations, l’approche par étapes est la suivante pour les arbres de décision suivants, menant à des ponts acceptables ou à des rejets :
Arbre de décision 1 : Composition qualitative et quantitative identique, et caractérisation physico-chimique et structurale identique
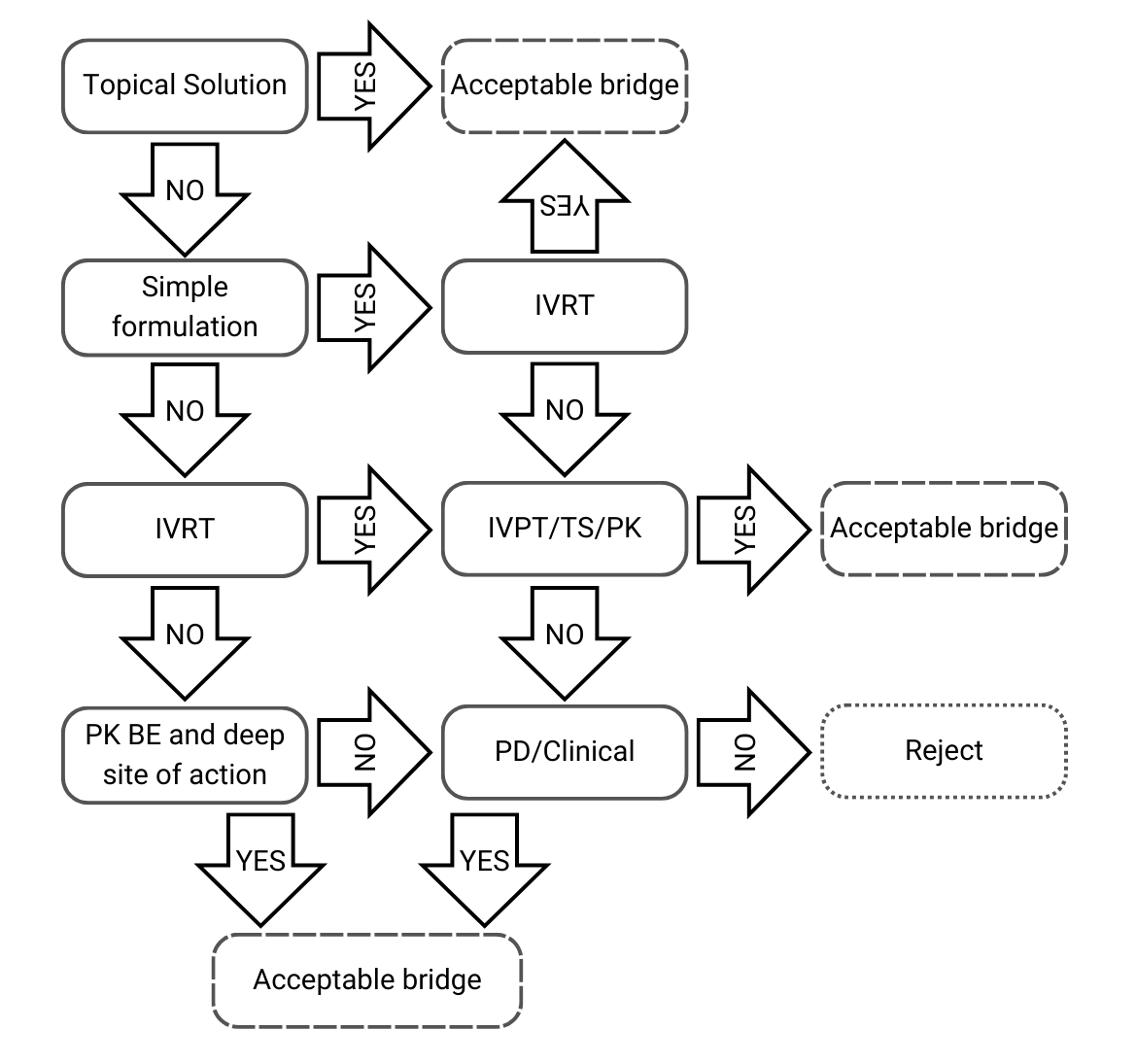
Figure 2) Arbre de décision 1 issu des lignes directrices de l’EMA
Arbre de décision 2 : Petites différences dans les compositions qualitatives et quantitatives, et/ou dans la caractérisation physico-chimique et structurale
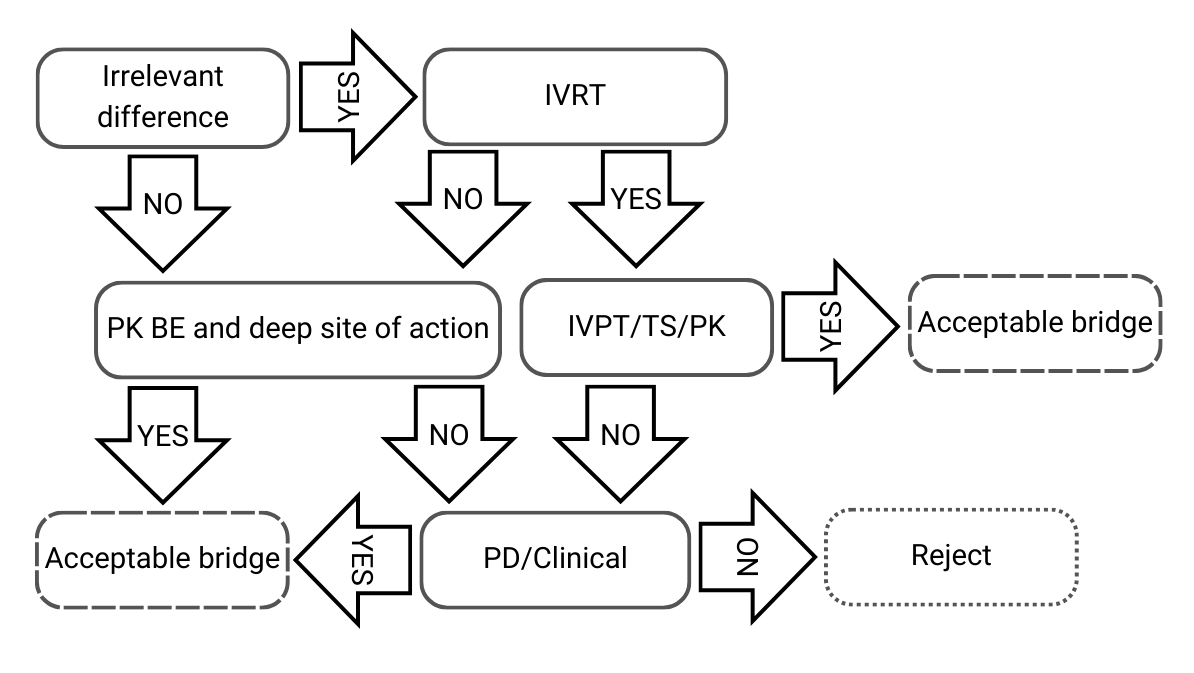
Figure 3) Arbre de décision 2 issu des lignes directrices de l’EMA
Arbre de décision 3 : Différentes compositions qualitatives et quantitatives et différentes caractérisations physico-chimiques et structurales
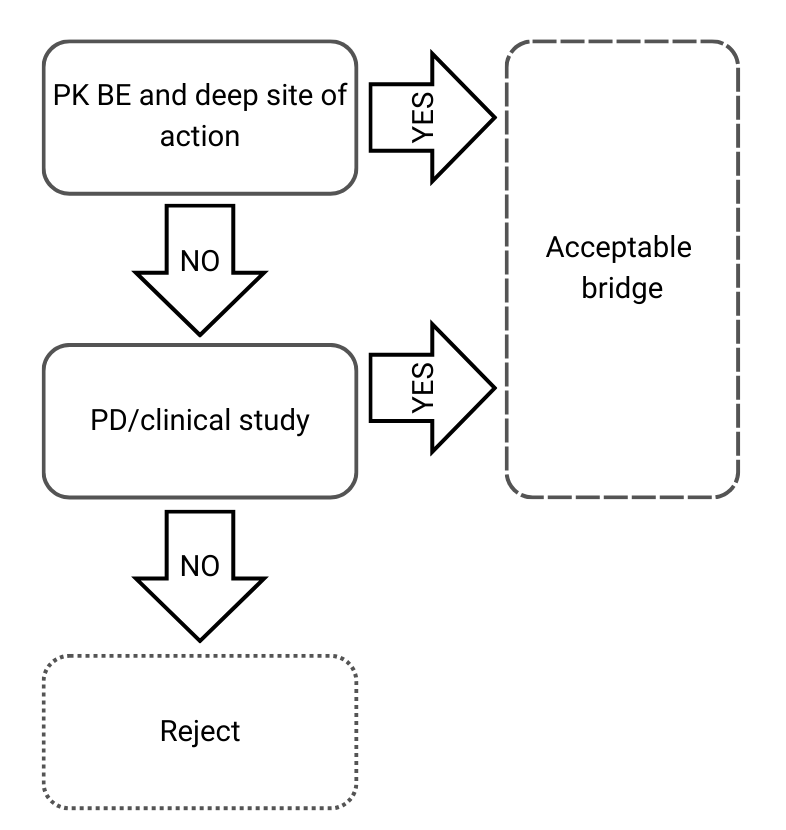
Figure 4) Arbre de décision 3 issu des lignes directrices de l’EMA
Comme le montrent ces arbres de décision, en fonction des similitudes entre les produits, l’EMA propose différentes approches progressives que les fabricants devraient envisager.
Expérience du groupe Kymos avec les études IVRT et IVPT
Le groupe Kymos dispose d’une équipe spécialisée dans la libération de médicaments et les techniques d’application topique depuis 2017 et possède une vaste expérience des études IVRT et IVPT. Nos méthodes ont été développées conformément à la version préliminaire de cette même directive de 2018, et nos scientifiques sont déjà familiarisés avec la version finale.
Nous avons divisé notre catalogue de services de libération de médicaments et d’absorption percutanée en deux groupes principaux :
- IVRT : Nous mesurons les quantités et les vitesses de libération du médicament à l’aide de membranes artificielles afin de développer et de valider des méthodes pour différentes formulations. Ces méthodes peuvent être utilisées dans des études comparatives pour évaluer l’équivalence et également pour effectuer le contrôle de la qualité des lots de fabrication.
- IVPT : Nous mesurons les quantités ayant pénétré la peau par voie transdermique, les débits de flux et la distribution dans les différentes couches cutanées pour les études de bioéquivalence. Nous pouvons également contribuer à l’optimisation et à la comparaison des formulations grâce à des études d’absorption percutanée.
Notre laboratoire est l’un des rares établissements européens à proposer des tests d’absorption percutanée certifiés BPL et BPF pour les produits cutanés avec les instruments automatisés de diffusion verticale Hanson Phoenix les plus récents (tests sur cellules Franz).
Grâce à sa parfaite connaissance des nouvelles directives, notre équipe scientifique est prête à accompagner ses clients depuis le développement de formulations jusqu’à la soumission réglementaire de nouvelles demandes d’autorisation de mise sur le marché, mais aussi pour les produits cutanés qui souhaitent démontrer leur équivalence avec les médicaments existants en suivant l’approche progressive de l’EMA.
Conclusions
L’adoption de la nouvelle ligne directrice de l’EMA sur la qualité et l’équivalence des produits topiques constitue une avancée majeure vers une approche plus harmonisée et structurée de l’analyse de ces médicaments. Ses recommandations progressives pour démontrer l’équivalence à l’aide de techniques telles que l’IVRT et l’IVPT simplifient la mise sur le marché de nouveaux génériques en évitant le recours à des études cliniques coûteuses et chronophages.
En tant que CRO leader dans le domaine de l’IVRT et de l’IVPT, le groupe Kymos et son équipe sont prêts à accompagner leurs clients et partenaires à chaque étape, garantissant un processus d’approbation de mise sur le marché en Europe sans encombre, conformément aux dernières directives.
Pour toute information complémentaire concernant les recommandations de l’EMA ou pour toute assistance relative à vos projets d’absorption percutanée, veuillez contacter commercial@kymos.com . Nous serons ravis de vous fournir des conseils et un accompagnement personnalisés.

